Was wäre, wenn wir nicht nur die Struktur des Herzens, sondern auch die tatsächliche Funktionsweise sehen könnten? Genau das ermöglicht die nukleare Kardiologie.
Die nukleare Kardiologie verwendet radioaktive Tracer, um die Herzfunktion, den Blutfluss und die Gewebeviabilität zu bewerten. Sie ermöglicht eine frühzeitige, nicht-invasive Diagnose von Erkrankungen wie koronarer Herzkrankheit und kardialer Amyloidose und bietet präzisere und individuellere kardiologische Betreuung.
Erfahren Sie, wie Technologien wie PET, SPECT, KI und neuartige Radiotracer die Zukunft der kardialen Diagnostik verändern.

Was ist nukleare Kardiologie?
Die nukleare Kardiologie ist eine Subdisziplin der kardiovaskulären Bildgebung , die zeigt, wie das Herz funktioniert. Sie verwendet kleine Mengen radioaktiver Substanzen (Radiotracer), um den Blutfluss zu verfolgen, die Aktivität des Herzmuskels zu messen und die Herzgesundheit von innen heraus zu bewerten.
Im Gegensatz zu CT- oder MRT-Untersuchungen, die die physische Struktur des Herzens zeigen, konzentriert sich die nukleare Kardiologie auf Stoffwechsel, Perfusion und Funktion. Das bedeutet, dass sie erkennen kann, ob ein Teil des Herzens genügend Blut erhält und ob es noch lebensfähig ist, lange bevor strukturelle Schäden in einem Standardscan sichtbar werden.
Dieser Ansatz ist entscheidend geworden für die Diagnose komplexer oder frühzeitiger Herzkrankheiten. Beispielsweise kann eine Koronararterie auf einem Angiogramm verengt erscheinen.
Ist diese Blockade wirklich für den Blutfluss verantwortlich?
Die nukleare Kardiologie beantwortet diese Frage mit Klarheit.
Sie ermöglicht auch sicherere, nicht-invasive Tests bei Patienten, die sonst möglicherweise invasivere Verfahren wie Biopsien oder Katheteruntersuchungen benötigen.
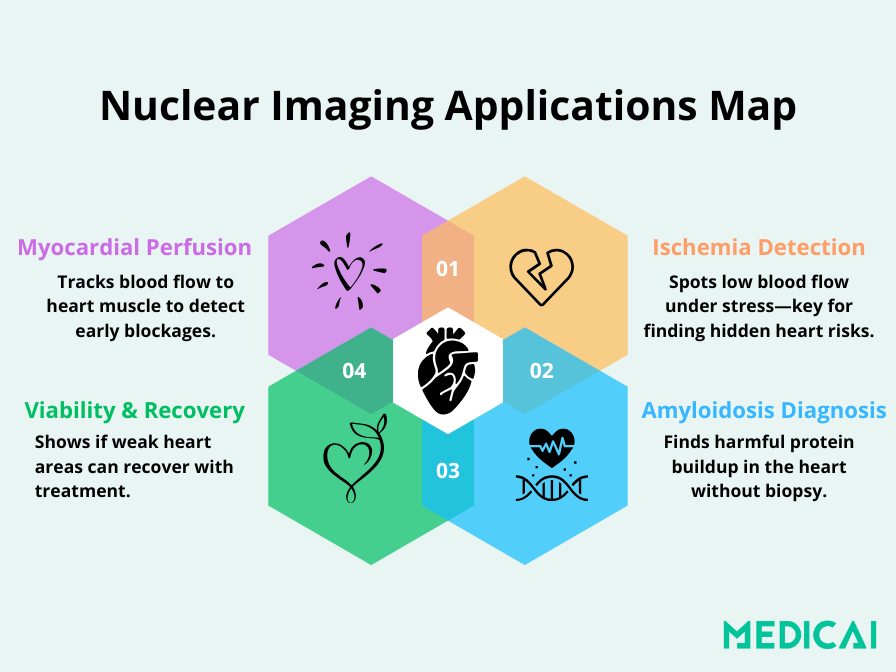
Kernanwendungen der nuklearen Kardiologie in der klinischen Praxis
Die nukleare Kardiologie wird häufig eingesetzt, um:
- Die Myokardperfusion (Blutfluss zum Herzmuskel) zu bewerten
- Die koronare Herzkrankheit (KHK) zu diagnostizieren oder zu überwachen
- Schäden nach einem Herzinfarkt zu bewerten
- Festzustellen, ob Patienten Stents oder Bypass-Operationen benötigen
- Die Auswirkungen kardiotoxischer Behandlungen (wie Chemotherapie) zu überwachen
- Seltene Erkrankungen wie die kardiale Amyloidose zu erkennen ohne Biopsie Die nukleare Kardiologie ermöglicht es Klinikern, Herzprobleme zu erkennen, bevor die Symptome schwerwiegend oder bemerkbar werden. Deshalb ist sie wichtig für das Screening von Hochrisikopatienten, die Nachverfolgung der Genesung nach Operationen und die Optimierung langfristiger Behandlungsstrategien.
Nuclear cardiology lets clinicians detect heart problems before symptoms become severe or noticeable. That’s why it is key in screening high-risk patients, tracking recovery after surgery, and optimizing long-term treatment strategies.
Im Wesentlichen verlagert die nukleare Kardiologie den Fokus von der Erscheinung des Herzens auf die Leistung des Herzens, und dieser Wandel rettet Leben.
Von der Biopsie zum Durchbruch: Nukleare Bildgebung in der kardialen Diagnose
Bestimmte Herzerkrankungen, insbesondere die kardiale Amyloidose, wurden früher mittels einer als Endomyokardbiopsie bezeichneten Prozedur diagnostiziert. Auch wenn sie effektiv ist, ist sie invasiv, erfordert das Einfügen eines Katheters in das Herz und birgt Risiken wie Blutungen, Infektionen oder sogar Perforationen.
Sie erfordert auch eine fachkundige Ausbildung und hochspezialisierte Zentren.
Heute verändert die nukleare Kardiologie dies. Durch den Einsatz zielgerichteter Radiotracer können Klinikern Amyloidablagerungen im Herzen nicht-invasiv erkennen, oft mit gleicher oder größerer Genauigkeit, und lange bevor die Symptome schwerwiegend werden.
Eine der wirksamsten Veränderungen besteht darin, die kardiale Amyloidose zu diagnostizieren, eine Erkrankung, bei der fehlgefaltete Proteine im Herzen ansammeln, wodurch es steif und weniger effizient wird. Es gibt zwei Haupttypen:
- ATTR-Amyloidose, die mit dem Transthyretin-Protein verbunden ist und oft altersbedingt ist
- AL-Amyloidose, die mit leichten Ketten von Plasmazellen verbunden ist
Diese Subtypen erfordern völlig unterschiedliche Behandlungen, weshalb eine frühzeitige, genaue Differenzierung entscheidend ist. Die nukleare Bildgebung macht dies möglich.
Anstelle einer Gewebeentnahme verwenden Kliniker knochenbindende Tracer wie 99mTc-PYP oder 99mTc-DPD, um ATTR mit hoher Sicherheit zu diagnostizieren. Wenn die AL-Amyloidose ausgeschlossen werden muss, werden Labortests für Serum- und Urinproteine hinzugefügt.
Für komplexere Fälle bieten PET-Tracer wie 11C-PiB oder 18F-Flurbetaben eine noch größere Spezifität, insbesondere bei der Erkennung von AL-Beteiligung und der Überwachung des Therapieansprechens.
Was früher eine komplexe, im Krankenhaus durchgeführte Biopsie war, kann jetzt durch einen Scan und einige Blutuntersuchungen ersetzt werden. Dieser Durchbruch verbessert die Diagnosetimelines, den Komfort der Patienten und den Zugang zur Betreuung.
Weitere Studien zeigen, dass bildgebende Verfahren diagnostizieren und die Prognose vorhersagen sowie die Wirksamkeit der Behandlung verfolgen, wodurch eine personalisierte kardiologische Betreuung ermöglicht wird.

Myokardperfusion Bildgebung (MPI): Das Herz der nuklearen Kardiologie
Die Myokardperfusion Bildgebung oder MPI ist eine der etabliertesten und vertrauenswürdigsten Techniken in der nuklearen Kardiologie. Es ist ein nicht-invasiver Scan, der bewertet, wie gut das Blut zum Herzmuskel fließt.
MPI vergleicht die Perfusion in Ruhe und unter Stress, um Klinikern zu helfen, Bereiche des Herzens zu identifizieren, die möglicherweise nicht genug sauerstoffreiches Blut erhalten, bevor Symptome wie Brustschmerzen oder Müdigkeit schlimmer werden.
Dieser duale Ansatz ist entscheidend. Wenn eine Herzregion unter Stress einen reduzierten Blutfluss zeigt, aber in Ruhe normal aussieht, signalisiert dies typischerweise eine reversible Ischämie. Es ist ein Warnsignal für potenziell signifikante koronare Herzkrankheit (KHK).
Andererseits deutet ein Defekt, der sowohl in Stress- als auch in Ruhe-Scans vorhanden ist, auf Narbengewebe oder vorherige Myokardschäden hin.
Die Wissenschaft hinter dem Scan
Radiotracer sind zentral für die Funktion von MPI. Nachdem sie in den Blutkreislauf injiziert wurden, ahmen diese Substanzen die Blutflussmuster nach und sammeln sich in gesundem Herzgewebe an. Bereiche, die weniger Tracer aufnehmen, erscheinen als „kalte Stellen“ im Scan und zeigen eine schlechte Perfusion an.
Häufig verwendete Tracer für MPI sind:
- Technetium-99m-Verbindungen, wie Sestamibi (MIBI) und Tetrofosmin, werden aufgrund ihrer guten Bildqualität und günstigen Halbwertszeit häufig in der SPECT-Bildgebung eingesetzt.
- Thallium-201, ein älterer Tracer mit längerer Halbwertszeit, wird immer noch in ausgewählten Fällen zur Beurteilung der Viabilität eingesetzt.
- PET-Tracer wie Rubidium-82, Stickstoff-13 Ammoniak und das neu von der FDA genehmigte F18-Flurpiridaz bieten hohe Auflösung zur Bewertung des Verdachts auf KHK.
Jeder Tracer hat seine Stärken, aber sie zielen alle darauf ab, dasselbe zu tun: zu zeigen, wie gut Blut unter verschiedenen Bedingungen das Herz erreicht.
Warum ist MPI in der klinischen Praxis wichtig?
MPI ist mehr als nur ein Diagnosetool; es ist oft der erste Scan, um ernsthafte Gesundheitsprobleme zu identifizieren. Kliniker verlassen sich auf MPI, um:
- Die koronare Herzkrankheit (KHK) zu erkennen, selbst bevor sie bemerkbare Symptome verursacht
- Die Schwere der Blutflusslimitierung zu bewerten, insbesondere wenn physischer oder pharmakologischer Stress versteckte Ischämie aufdeckt
- Das Risiko zukünftiger Herzinfarkte und kardiologischer Todesfälle zu bewerten
- Behandlungsstrategien zu leiten, z.B. die Wahl zwischen Medikation, Angioplastie oder Bypass-Operation
- Die Genesung nach einem Herzinfarkt oder chirurgischen Eingriff zu überwachen
MPI hat einen signifikanten prognostischen Wert, da normale Ergebnisse ein niedriges jährliches Risiko für kardiologische Ereignisse anzeigen, das dem der Allgemeinbevölkerung entspricht. Wenn Anomalien festgestellt werden, hilft das Ausmaß des reduzierten Blutflusses bei der Risikostratifizierung und beeinflusst die Behandlungsplanung.
SPECT vs. PET: Die richtige Modalität wählen
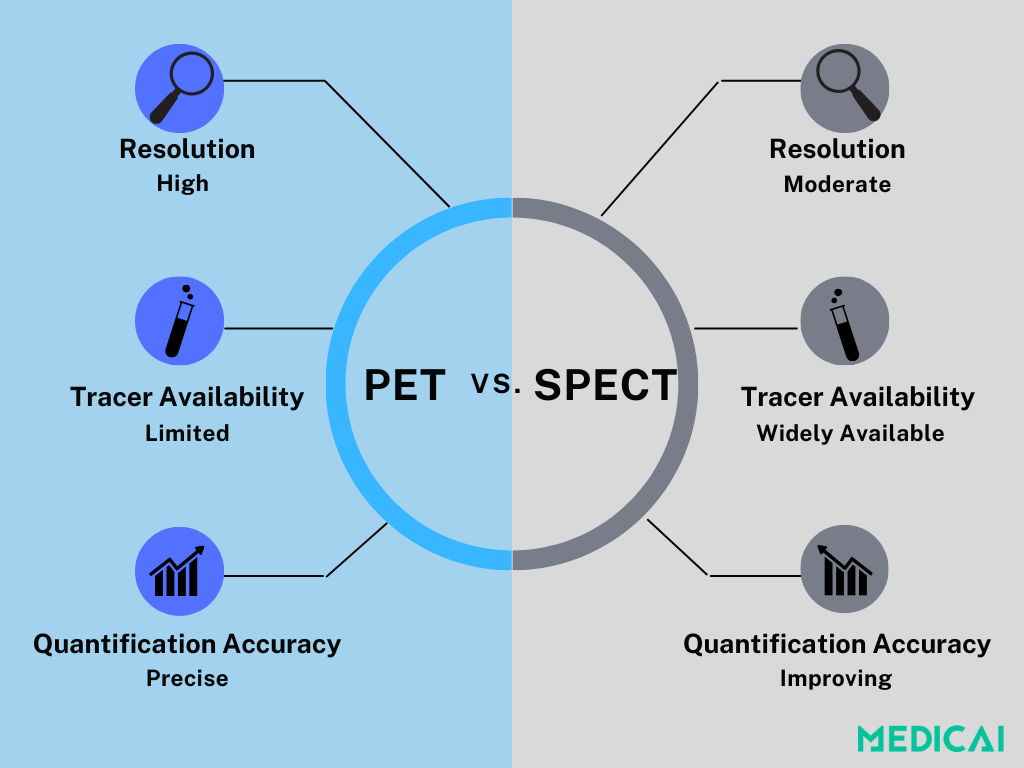
Sowohl SPECT als auch PET werden in der Myokardperfusion Bildgebung (MPI) verwendet, unterscheiden sich jedoch in wichtigen Bereichen: Auflösung, quantitative Genauigkeit, Verfügbarkeit und Kosten.
PET ist der Goldstandard zur Quantifizierung des Myokardblutflusses (MBF). Die höhere räumliche Auflösung und die Möglichkeit, den Blutfluss in absoluten Werten zu messen, machen es besonders nützlich zur Bewertung komplexer oder subtiler koronarer Erkrankungen.
Allerdings bleibt PET durch Kosten und Zugänglichkeit eingeschränkt. Spezialisierte Tracer wie Rubidium-82, N-13 Ammoniak und F18-Flurpiridaz sind teuer und oft nicht verfügbar. Viele PET-Scanner sind auch für die Onkologie priorisiert, wodurch die Verwendung für kardiologische Zwecke in vielen Regionen weniger praktikabel ist.
Auf der anderen Seite ist SPECT viel zugänglicher und verwendet allgemein verfügbare Tracer wie Technetium-99m MIBI und Tetrofosmin. Auch wenn es nicht die Präzision von PET erreicht, haben neuere Technologien wie CZT (Cadmium-Zink-Tellurid) Detektoren die Bildqualität, Geschwindigkeit und Sensitivität erheblich verbessert.
Mit dynamischem SPECT und KI-unterstützter Rekonstruktion, die nun entwickelt wird, gewinnt SPECT an Boden als praktischere, kosteneffiziente Option zur Bewertung des MBF, insbesondere wo der Zugang zu PET begrenzt ist.
Da die Technologien von SPECT und CZT fortschreiten, können Lösungen wie Medicai die Bildqualität verbessern und Protokolle standardisieren, um die Leistungslücke zu PET zu schließen.
Letztendlich besteht die Wahl zwischen beiden darin, Leistung mit Praktikabilität zu balancieren. PET liefert unvergleichliche Quantifizierung, aber SPECT entwickelt sich schnell weiter, und für viele Kliniken ist es der realistischste Weg in der nuklearen Kardiologie.
Kardiale Amyloidose: Wie die nukleare Bildgebung die Diagnose neu definiert
Die kardiale Amyloidose wurde traditionell durch Biopsie diagnostiziert, ein riskantes und spezialisiertes Verfahren. Jetzt ermöglicht die nukleare Kardiologie eine nicht-invasive, frühzeitige Erkennung und Klassifikation dieser komplexen Erkrankung.
Amyloidose wird durch die Ansammlung von fehlgefalteten Proteinen im Herzen verursacht, die seine Funktionsfähigkeit beeinträchtigen. Zwei Haupttypen betreffen das Herz:
- ATTR (Transthyretin-Amyloidose) – oft altersbedingt oder erblich
- AL (leichte Ketten-Amyloidose) ist mit Plasmazellenerkrankungen verbunden
Diese beiden Typen unterscheiden sich in der Pathologie und Behandlung, daher ist die Unterscheidung zwischen ihnen entscheidend. Die Biopsie kann dies tun, ist jedoch invasiv. Die nukleare Bildgebung bietet nun eine sicherere Alternative.
Der Aufstieg der knochenbindenden Tracer
Der Einsatz von knochenbindenden Tracern wie 99mTc-PYP, 99mTc-DPD und 99mTc-HMDP hat die Diagnose der ATTR-Amyloidose erheblich verbessert. Eine starke Radiotracer-Aufnahme im Herzen (Grad 2 oder 3) zusammen mit regelmäßigen Blutuntersuchungen auf monoklonale Proteine bestätigt die Diagnose ohne dass eine Biopsie erforderlich ist.
Dieser Ansatz verbessert die Zugänglichkeit und ermöglicht eine frühere Krankheitsdiagnose, oft lange bevor irreversible Herzschäden auftreten.
PET-Bildgebung: Eine neue Grenze für die AL-Amyloidose
Während knochenbindende Tracer für ATTR hervorragend sind, sind sie weniger zuverlässig für AL-Amyloidose. Hier kommt die PET-Bildgebung ins Spiel.
Durch die Verwendung von Tracern wie 11C-PiB, 18F-Flurbetaben oder 18F-Flurbetapir kann PET direkt an Amyloidproteine binden und sowohl AL- als auch ATTR-Subtypen visualisieren, wobei eine Tendenz besteht, bei AL-Fällen sogar eine höhere Aufnahme zu zeigen.
Studien zeigen, dass PET hilft, Amyloidtypen zu unterscheiden und Einblicke in die Krankheitslast und das Ansprechen auf die Therapie gibt. Für AL-Amyloidose-Patienten, die sich einer Chemotherapie unterziehen, können Änderungen im PET-Signal auf die Wirksamkeit der Therapie hinweisen, was die Überwachung der Erkrankung revolutioniert.
Über die Perfusion hinaus: Das erweiterte Toolkit der nuklearen Kardiologie
Die Myokardperfusion Bildgebung (MPI) ist zentral in der nuklearen Kardiologie. Das Gebiet hat sich jedoch erweitert und umfasst Techniken zur Beurteilung des Myokardmetabolismus, der Nervenaktivität und der Gewebeviabilität, wodurch die kardiale Diagnostik in der Herzinsuffizienzpflege verbessert wird.
FDG-PET ist ein solches Werkzeug. Die Bildgebung der Glukoseaufnahme im Herzmuskel hilft, das ruhende Myokard zu erkennen. Dieses Gewebe ist lebendig, aber aufgrund chronisch geringer Blutzufuhr leistet es nur geringe Dienste. Der Bereich kann sich mit einer Revaskularisation wieder erholen, wenn Glukose aufgenommen wird, obwohl die Kontraktion schwach ist.
Das macht FDG-PET besonders wertvoll bei Patienten mit ischämischer linksventrikulärer Dysfunktion, da es Entscheidungen über Bypass-Operationen oder andere Interventionen leitet.
Eine weitere aufstrebende Option ist die Bildgebung mit Iod-123 mIBG, die die sympathische Innervation des Herzens bewertet. Eine reduzierte mIBG-Aufnahme bei Patienten mit Herzinsuffizienz wurde mit schlechteren Ergebnissen in Verbindung gebracht und bietet den Klinikern ein zusätzliches Werkzeug für die Risikobewertung und die Behandlungsplanung.
Obwohl nicht weit verbreitet, signalisieren diese Techniken einen Wandel vom bloßen Beobachten der Struktur des Herzens hin zum Verständnis seines metabolischen, elektrischen und funktionalen Verhaltens. Mit weiteren Beweisen sind sie bereit, die personalisierte kardiologische Betreuung zu verbessern.
KI und quantitative Bildgebung: Der nächste große Fortschritt
Während sich die nukleare Bildgebung weiterentwickelt, vereinfacht und verbessert KI den Prozess. Scans liefern detaillierte Daten zu Blutfluss, Funktion und Risiko, was ein effizientes Datenmanagement für schnellere Entscheidungen erforderlich macht.
KI ist besonders nützlich zur Quantifizierung des Myokardblutflusses (MBF), insbesondere in der PET-Bildgebung. Sie automatisiert die Bildrekonstruktion, Segmentierung und Flussanalyse und reduziert manuelle Schritte und Variabilität zwischen den Klinikern.
KI-Tools optimieren die Bildrekonstruktion, Segmentierung und Quantifizierung des Blutflusses. Plattformen wie Medicai integrieren Multimodalitätsdaten in Echtzeit-Entscheidungshilfen, reduzieren Variabilität und stärken das diagnostische Vertrauen.
KI unterstützt auch dynamisches SPECT, wo schnelle Bildgebung nötig ist, um den MBF zu schätzen. Mit besseren Algorithmen und Detektoren wie CZT kommt SPECT PET-Fähigkeiten immer näher.
Neben der Quantifizierung ist KI darauf trainiert, Ergebnisse vorherzusagen, indem sie Muster über Perfusion, Funktion und extrakardialer Aufnahme analysiert. Diese Modelle könnten Klinikern bald helfen, das Risiko genauer zu stratifizieren.
KI ersetzt keine Radiologen; sie verbessert deren Arbeit, macht die Bildgebung intelligenter und schneller und führt zu besseren personalisierten kardiologischen Diagnosen.
Fazit
Die nukleare Kardiologie transformiert die Herzversorgung, indem sie die Funktion über die Anatomie priorisiert und frühzeitigere und genauere Diagnosen ermöglicht. Zu den wichtigen Fortschritten gehören die Perfusionsbildgebung, KI-gesteuerte Quantifizierung und die Erkennung von Amyloidose durch Technologien wie PET, CZT-SPECT und funktionale Bildgebung.
Plattformen wie Medicai helfen Klinikern, kardiale Daten genauer und effizienter zu analysieren. Durch die Kombination von Automatisierung mit klinischem Wissen ermöglichen wir personalisierte und skalierbare kardiologische Diagnosen.




