Que se passerait-il si nous pouvions voir non seulement la structure du cœur, mais aussi son véritable fonctionnement ? C’est exactement ce que permet la cardiologie nucléaire.
La cardiologie nucléaire utilise des traceurs radioactifs pour évaluer la fonction cardiaque, le flux sanguin et la viabilité tissulaire. Elle permet un diagnostic précoce et non invasif de conditions telles que la cardiopathie coronarienne et l’amyloïdose cardiaque, offrant des soins cardiaques plus précis et personnalisés.
Découvrez comment des technologies comme la TEP, la SPECT, l’IA et de nouveaux radiotraceurs redéfinissent l’avenir du diagnostic cardiaque.

Qu’est-ce que la cardiologie nucléaire ?
La cardiologie nucléaire est une sous-spécialité de l’imagerie cardiovasculaire qui révèle comment fonctionne le cœur. Elle utilise des quantités infimes de substances radioactives (radiotraceurs) pour suivre le flux sanguin, mesurer l’activité du muscle cardiaque et évaluer la santé cardiaque de l’intérieur.
Contrairement aux scans CT ou IRM, qui montrent la structure physique du cœur, la cardiologie nucléaire se concentre sur le métabolisme, la perfusion et la fonction.. Cela signifie qu’elle peut détecter si une partie du cœur reçoit suffisamment de sang et si elle est encore viable, bien avant que des dommages structurels n’apparaissent sur un scan standard.
Cette approche est devenue essentielle pour diagnostiquer des conditions cardiaques complexes ou à un stade précoce. Par exemple, une artère coronarienne peut apparaître rétrécie sur une angiographie.
Cependant, ce blocage restreint-il réellement le flux sanguin ?
La cardiologie nucléaire répond à cette question avec clarté.
Elle permet également des tests plus sûrs et non invasifs pour les patients qui pourraient autrement nécessiter des procédures plus invasives, comme des biopsies ou une cathétérisme.
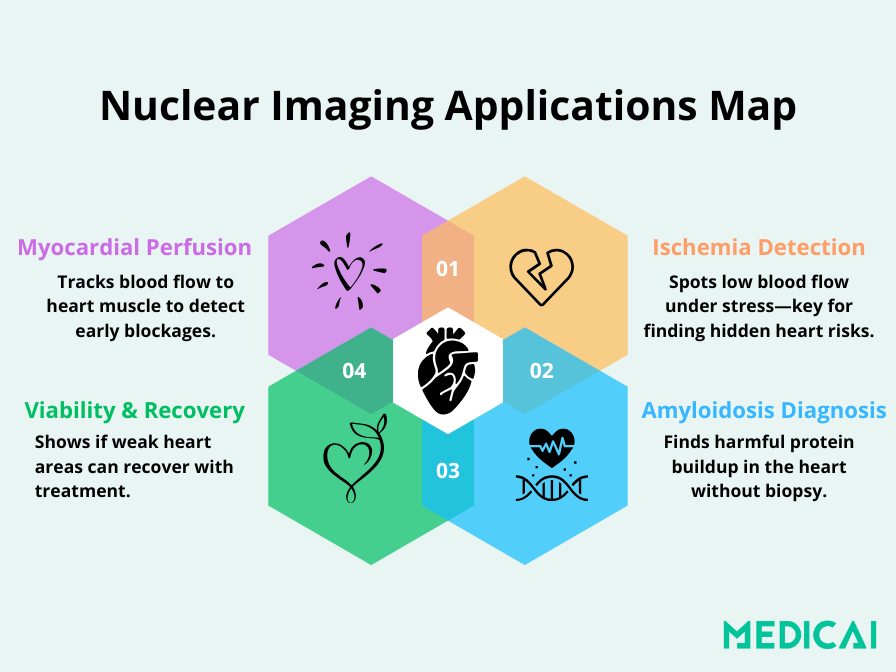
Applications principales de la cardiologie nucléaire en pratique clinique
La cardiologie nucléaire est largement utilisée pour :
- Évaluer la perfusion myocardique (flux sanguin vers le muscle cardiaque)
- Diagnostiquer ou surveiller la cardiopathie coronarienne (CAD)
- Évaluer les dommages après une crise cardiaque
- Déterminer si les patients ont besoin de stents ou d’une chirurgie de pontage
- Surveiller les effets des traitements cardiotoxiques (comme la chimiothérapie)
- Détecter des maladies rares comme l’amyloïdose cardiaque sans nécessiter de biopsie.
La cardiologie nucléaire permet aux cliniciens de détecter des problèmes cardiaques avant que les symptômes ne deviennent sévères ou notables. C’est pourquoi elle est essentielle pour le dépistage des patients à haut risque, le suivi de la récupération après une chirurgie et l’optimisation des stratégies de traitement à long terme.
En essence, la cardiologie nucléaire déplace l’accent de l’apparence du cœur à ses performances, et ce changement sauve des vies.
De la biopsie à la percée : L’imagerie nucléaire dans le diagnostic cardiaque.
Certaines affections cardiaques, en particulier l’amyloïdose cardiaque, étaient autrefois diagnostiquées par une procédure appelée biopsie endomyocardique. Bien que efficace, c’est invasif, nécessite l’insertion d’un cathéter dans le cœur et comporte des risques comme des saignements, des infections ou même des perforations.
Cela nécessite également une formation spécialisée et des centres hautement spécialisés.
Aujourd’hui, la cardiologie nucléaire change cela. En utilisant des radiotraceurs ciblés, les cliniciens peuvent détecter des dépôts d’amyloïde dans le cœur de manière non invasive,souvent avec une précision égale ou supérieure, et bien avant que les symptômes ne deviennent sévères.
Un des changements les plus impactants est le diagnostic de l’amyloïdose cardiaque, une condition où des protéines mal repliées s’accumulent dans le cœur, le rendant rigide et moins efficace. Il y a deux types principaux :
- l’amyloïdose ATTR, liée à la protéine transthyrétine et souvent liée à l’âge,
- l’amyloïdose AL, impliquant les chaînes légères des cellules plasmatiques.
Ces sous-types nécessitent des traitements entièrement différents, ce qui rend la distinction précoce et précise cruciale. L’imagerie nucléaire rend cela possible.
Au lieu d’un échantillon de tissu, les cliniciens utilisent des traceurs avides d’os comme le 99mTc-PYP ou le 99mTc-DPD pour diagnostiquer l’ATTR avec une grande confiance. Lorsque l’amyloïdose AL doit être exclue, des tests de laboratoire pour les protéines sériques et urinaires sont ajoutés.
Pour les cas plus complexes, des traceurs TEP comme 11C-PiB ou 18F-florbébén offrent une spécificité encore plus grande, en particulier pour détecter l’implication AL et surveiller la réponse au traitement.
Ce qui était autrefois une biopsie complexe en milieu hospitalier peut maintenant être remplacé par un scan et quelques tests sanguins. Cette percée améliore les délais de diagnostic, le confort des patients et l’accès aux soins.
D’autres études montrent que les outils d’imagerie diagnostiquent, prédisent le pronostic et suivent l’efficacité du traitement, permettant des soins cardiaques plus personnalisés.

Imagerie de la perfusion myocardique (MPI) : Le cœur de la cardiologie nucléaire.
L’imagerie de la perfusion myocardique, ou MPI, est l’une des techniques les plus établies et reconnues en cardiologie nucléaire. Il s’agit d’un scan non invasif qui évalue comment le sang circule vers le muscle cardiaque.
La MPI compare la perfusion au repos et pendant le stress pour aider les cliniciens à identifier les zones du cœur qui peuvent manquer de sang oxygéné suffisant avant que des symptômes tels que des douleurs thoraciques ou de la fatigue ne s’aggravent.
Cette approche en deux phases est vitale. Lorsqu’une région cardiaque montre un flux sanguin réduit sous stress mais semble normale au repos, cela signale généralement une ischémie réversible. C’est un signe d’une cardiopathie coronarienne (CAD) potentiellement significative.
D’autre part, si un défaut est présent à la fois dans les scans de stress et de repos, cela suggère un tissu cicatriciel ou des dommages myocardiques antérieurs.
La science derrière le scan.
Les radiotraceurs sont centraux au fonctionnement de la MPI. Une fois injectées dans le sang, ces substances imitent les schémas de flux sanguin et s’accumulent dans les tissus cardiaques sains. Les zones qui prennent moins de traceurs apparaissent comme des « zones froides » sur le scan, indiquant une mauvaise perfusion.
Les traceurs courants utilisés pour la MPI incluent :
- Les composés de technétium-99m, tels que le sestamibi (MIBI) et le tétrafosmine, sont largement utilisés dans l’imagerie SPECT en raison de la bonne qualité d’image et de la demi-vie favorable.
- Le thallium-201, un traceur plus ancien avec une demi-vie plus longue, est encore utilisé dans certaines situations pour l’évaluation de la viabilité.
- Les traceurs TEP comme le rubidium-82, l’ammoniaque azote-13 et le nouvel F18-Flurpiridaz approuvé par la FDA offrent une haute résolution pour évaluer une CAD suspectée.
Chaque traceur a ses forces, mais tous visent à faire la même chose : montrer à quel point le sang atteint bien le cœur dans différentes conditions.
Pourquoi la MPI est-elle importante en pratique clinique ?
La MPI est plus qu’un simple outil de diagnostic; c’est souvent le premier scan à identifier des problèmes de santé graves. Les cliniciens s’appuient sur la MPI pour :
- Détecter la cardiopathie coronarienne (CAD), même avant qu’elle ne provoque des symptômes notables.
- Évaluer la gravité de la limitation du flux sanguin, surtout lorsque le stress physique ou pharmacologique découvre une ischémie cachée.
- Évaluer le risque de futurs infarctus et de décès cardiaque.
- Orienter les stratégies de traitement, comme le choix entre un médicament, une angioplastie ou une chirurgie de pontage.
- Surveiller la récupération après un infarctus ou une procédure chirurgicale.
La MPI a une valeur pronostique importante, avec des résultats normaux indiquant un faible risque annuel d’événements cardiaques similaire à celui de la population générale. Lorsque des anomalies sont détectées, le degré de réduction du flux sanguin aide à la stratification des risques et influence la planification du traitement.
SPECT contre PET : Choisir la bonne modalité.
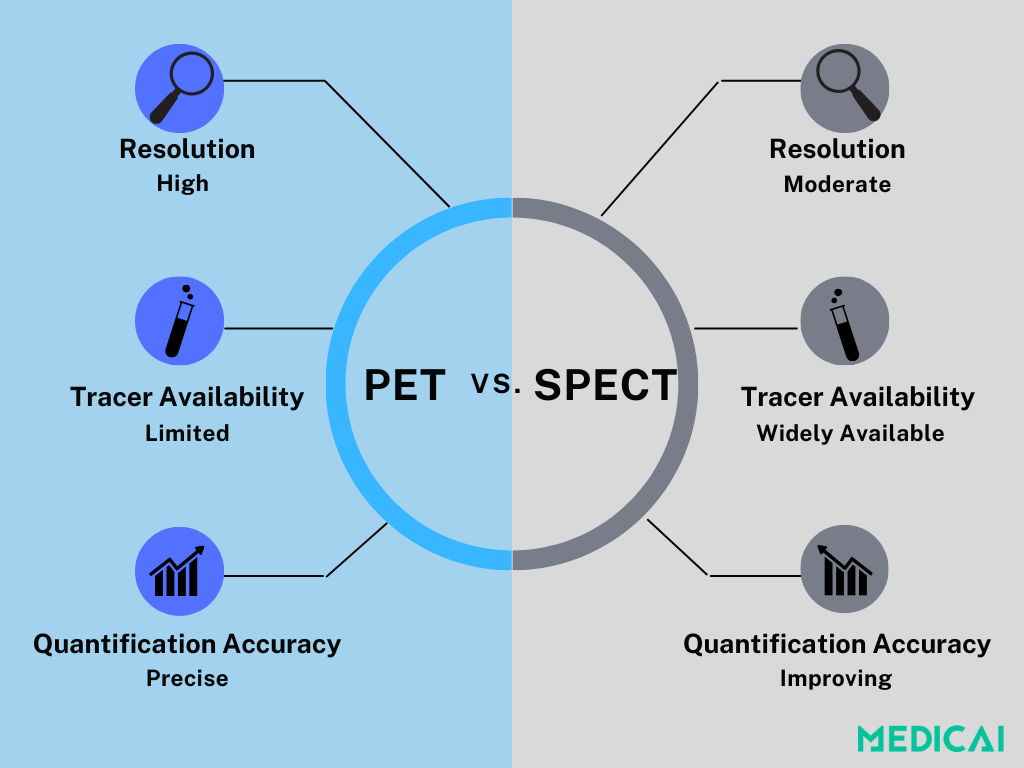
Bien que le SPECT et la TEP soient utilisés dans l’imagerie de la perfusion myocardique (MPI), ils diffèrent dans des domaines clés : la résolution, la précision de quantification, la disponibilité et le coût.
La TEP est la norme d’or pour quantifier le flux sanguin myocardique (MBF). Sa résolution spatiale plus élevée et sa capacité à mesurer le flux sanguin en termes absolus la rendent particulièrement utile pour évaluer des maladies coronariennes complexes ou subtiles.
Cependant, la TEP reste limitée par le coût et l’accessibilité. Les traceurs spécialisés comme le rubidium-82, l’ammoniaque N-13 et le F18-Flurpiridaz sont coûteux et indisponibles. De nombreux scanner TEP sont également priorisés pour l’oncologie, rendant l’utilisation cardiaque moins réalisable dans de nombreuses régions.
En revanche, le SPECT est beaucoup plus accessible et utilise des traceurs largement disponibles comme le technétium-99m MIBI et le tétrafosmine. Bien qu’il ne corresponde pas à la précision de la TEP, de nouvelles technologies comme les détecteurs CZT (séléniure de cadmium et de zinc) ont considérablement amélioré la qualité d’image, la vitesse et la sensibilité.
Avec le SPECT dynamique et la reconstruction assistée par IA maintenant en développement, le SPECT gagne du terrain comme option plus pratique et rentable pour l’évaluation du MBF, en particulier là où l’accès à la TEP est limité.
À mesure que les technologies SPECT et CZT avancent, des solutions comme Medicai peuvent améliorer la qualité des images et standardiser les protocoles, aidant à réduire l’écart de performance de la TEP.
En fin de compte, choisir entre les deux est une question d’équilibre entre performance et praticité. La TEP offre une quantification inégalée, mais le SPECT évolue rapidement, et pour de nombreuses cliniques, c’est la voie la plus réaliste à suivre en cardiologie nucléaire.
Amyloïdose cardiaque : Comment l’imagerie nucléaire redéfinit le diagnostic.
L’amyloïdose cardiaque était traditionnellement diagnostiquée par biopsie, une procédure risquée et spécialisée. Maintenant, la cardiologie nucléaire permet une détection non invasive, plus précoce et une classification de cette condition complexe.
L’amyloïdose est causée par l’accumulation de protéines mal repliées dans le cœur, ce qui interfère avec sa capacité à fonctionner correctement. Deux types principaux affectent le cœur :
- l’ATTR (amyloïdose transthyrétine) – souvent liée à l’âge ou héréditaire.
- l’AL (amyloïdose à chaîne légère) est associée à des troubles des cellules plasmatiques.
Ces deux types diffèrent en pathologie et en traitement, il est donc crucial de les différencier. La biopsie peut le faire, mais c’est invasif. L’imagerie nucléaire offre maintenant une alternative plus sûre.
L’essor des traceurs avides d’os.
L’utilisation de traceurs avides d’os tels que le 99mTc-PYP, le 99mTc-DPD et le 99mTc-HMDP a considérablement amélioré le diagnostic de l’amyloïdose ATTR. Une forte prise de radiotraceur dans le cœur (Grade 2 ou 3) associée à des tests sanguins réguliers pour les protéines monoclonales confirme le diagnostic sans nécessiter de biopsie.
Cette approche améliore l’accessibilité et permet une détection précoce de la maladie, souvent avant que des dommages cardiaques irréversibles ne se produisent.
Imagerie TEP : Une nouvelle frontière pour l’amyloïdose AL.
Bien que les traceurs osseux soient excellents pour l’ATTR, ils sont moins fiables pour l’amyloïdose AL. C’est là que l’imagerie TEP entre en jeu.
Utilisant des traceurs tels que le 11C-PiB, le 18F-florbébén, ou le 18F-florétapir, la TEP peut se lier directement aux protéines amyloïdes et visualiser à la fois les sous-types AL et ATTR, avec une tendance à montrer une prise encore plus grande dans les cas AL.
Des études montrent que la TEP aide à différencier les types d’amyloïde et fournit des informations sur la charge de la maladie et la réponse au traitement. Pour les patients atteints d’amyloïdose AL sous chimiothérapie, les changements du signal TEP peuvent indiquer l’efficacité de la thérapie, révolutionnant la surveillance de la maladie.
Au-delà de la perfusion : L’arsenal en expansion de la cardiologie nucléaire.
L’imagerie de la perfusion myocardique (MPI) est centrale à la cardiologie nucléaire. Cependant, le domaine s’est élargi pour inclure des techniques d’évaluation du métabolisme myocardique, de l’activité nerveuse et de la viabilité tissulaire, améliorant ainsi les diagnostics cardiaques dans les soins à l’insuffisance cardiaque.
Le FDG-TEP est un tel outil. L’imagerie de l’absorption de glucose dans le muscle cardiaque aide à détecter le myocarde en hibernation. Ce tissu est vivant mais fonctionne mal en raison d’un faible flux sanguin chronique. La zone peut récupérer avec la revascularisation si le glucose est absorbé malgré une contraction faible.
Cela rend le FDG-TEP particulièrement précieux chez les patients ayant une dysfonction ventriculaire gauche ischémique, guidant les décisions concernant la chirurgie de pontage ou d’autres interventions.
Une autre option émergente est l’imagerie mIBG à l’iode-123, qui évalue l’innervation sympathique du cœur. Une réduction de l’absorption de mIBG chez les patients souffrant d’insuffisance cardiaque a été liée à de pires résultats, offrant aux cliniciens un outil supplémentaire pour l’évaluation des risques et la planification des traitements.
Bien que pas largement adoptées, ces techniques signifient un changement d’une simple observation de la structure du cœur vers la compréhension de son comportement métabolique, électrique et fonctionnel. À mesure que de plus en plus de preuves émergent, elles sont prêtes à améliorer les soins cardiaques personnalisés.
IA et imagerie quantitative : Le prochain saut en avant.
À mesure que l’imagerie nucléaire évolue, l’IA simplifie et enhance le processus. Les scans fournissent des données détaillées sur le flux sanguin, la fonction et le risque, rendant la gestion efficace des données cruciale pour une prise de décision plus rapide.
L’IA est particulièrement utile pour quantifier le flux sanguin myocardique (MBF), notamment en imagerie TEP. Elle automatise la reconstruction d’image, la segmentation et l’analyse de flux, réduisant les étapes manuelles et la variabilité entre les cliniciens.
Les outils d’IA rationalisent la reconstruction d’images, la segmentation et la quantification du flux sanguin. Des plateformes comme Medicai intègrent des données multimodales dans des outils d’aide à la décision en temps réel, réduisant la variabilité et améliorant la confiance diagnostique.
L’IA soutient également le SPECT dynamique, où une imagerie rapide est nécessaire pour estimer le MBF. Avec de meilleurs algorithmes et des détecteurs comme le CZT, le SPECT se rapproche des capacités de la TEP.
Au-delà de la quantification, l’IA est formée pour prédire les résultats en analysant des motifs à travers la perfusion, la fonction et l’absorption extracardiaque. Ces modèles pourraient bientôt aider les cliniciens à stratifier les risques avec plus de précision.
L’IA ne remplace pas les radiologistes ; elle améliore leur travail, rendant l’imagerie plus intelligente et rapide, et conduisant à de meilleurs diagnostics cardiaques personnalisés.
Conclusion
La cardiologie nucléaire transforme les soins cardiaques en privilégiant la fonction sur l’anatomie, permettant des diagnostics plus précoces et plus précis. Les avancées clés comprennent l’imagerie de perfusion, la quantification guidée par IA et la détection de l’amyloïdose à travers des technologies comme la TEP, le SPECT CZT et l’imagerie fonctionnelle.
Des plateformes comme Medicai aident les cliniciens à analyser les données cardiaques de manière plus précise et efficace. En mêlant automatisation et insights cliniques, nous rendons possibles des diagnostics cardiaques personnalisés et évolutifs.




