Was ist, wenn Ihr nächster MRT-Bericht für das Herz eintrifft, bevor Sie Ihren Kaffee fertig getrunken haben?
Vollautomatische Deep-Learning-Segmentierung kombiniert einen CNN-unterstützten ROI-Detektor, ein U-Net-basiertes Rückgrat und die Verfeinerung durch deformierbare Modelle, um pixelgenaue Kammermasken in Sekunden zu liefern. Das Ergebnis sind klinische Konturen, Dice-Werte über 0,90 und reproduzierbare Messungen der Ejektionsfraktion.
Entdecken Sie die Architektur, Trainingsrezepte, Benchmark-Ergebnisse und reale Anwendungen, die eine schnelle, zuverlässige Segmentierung von Herz-MRTs zur Realität machen.

Warum revolutioniert Deep Learning die Herz-MRT?
Die Herz-MRT erfordert traditionell, dass Experten die Kammergrenzen manuell nachziehen, ein langsamer Prozess, der 15 bis 30 Minuten pro Scan in Anspruch nehmen kann und zwischen den Lesern variiert. Diese Inkonsistenzen können sich erheblich auf wichtige Metriken wie Ejektionsfraktion und Schlagvolumen auswirken, die für fundierte Behandlungsentscheidungen entscheidend sind.
Deep Learning MRI Segmentierung stellt diesen Workflow auf den Kopf.
Konvolutionale Netze lernen, Herzstrukturen direkt aus Bilddaten zu identifizieren. Nach dem Training produzieren sie in Sekunden pixelgenaue Konturen. Diese Geschwindigkeit ermöglicht die Lieferung von Berichten am selben Tag, sodass sich Spezialisten auf komplexe Fälle und nicht auf routinierte Ausmessungen konzentrieren können.
Über die Geschwindigkeit hinaus reduziert die automatisierte Segmentierung die Interbeobachtervariabilität. Studien zeigen, dass Deep-Learning-Modelle Dice-Werte über 0,90 sowohl für den linken als auch für den rechten Ventrikel erreichen – vergleichbar mit menschlichen Experten und oft besser. Konsistente Messungen schaffen Vertrauen bei den Kliniker:innen und unterstützen die zuverlässige Überwachung des Krankheitsverlaufs.
Moderne Netze passen sich schließlich an unterschiedliche Bildgebungsprotokolle an. Durch Datenaugmentation und robustes Training an multi-Anbieter-Datensätzen tolerieren sie Unterschiede in der Scanner-Marke, Feldstärke und den Erwerbsparametern. Diese Generalisierbarkeit bedeutet, dass dasselbe Modell in Krankenhäusern weltweit ohne mühsames Nachjustieren eingesetzt werden kann.

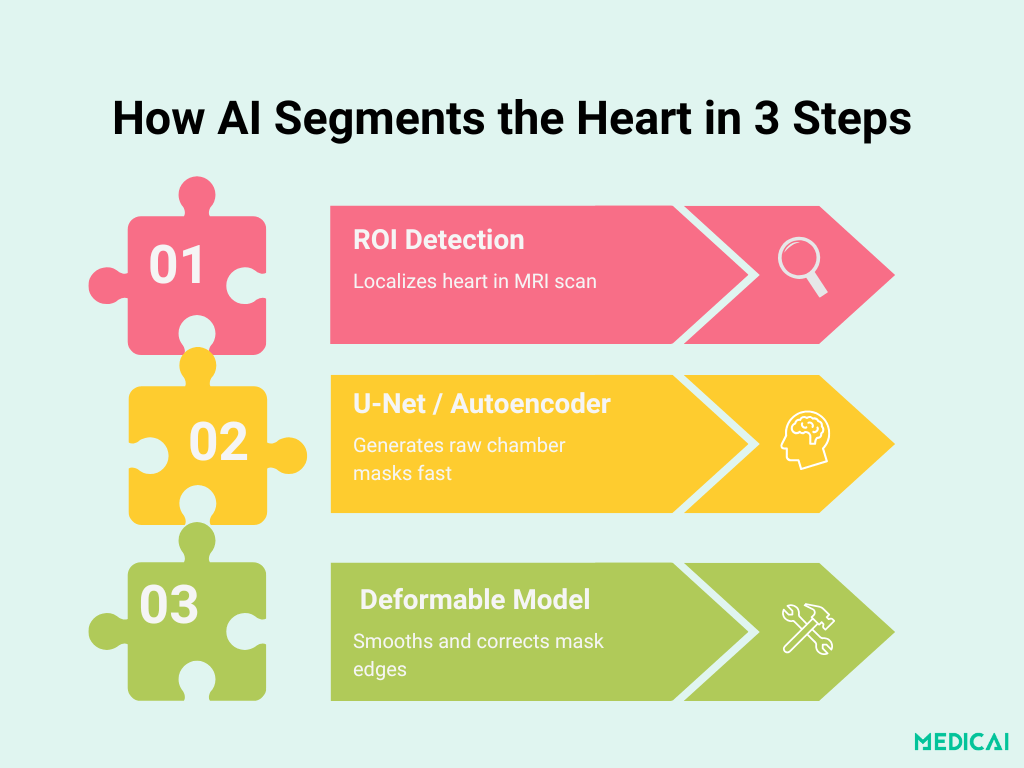
Anatomie der Pipeline: Vom ROI zur endgültigen Kontur
Die kamerabasierte Segmentierung auf Basis von Deep Learning entfaltet sich in drei klaren Phasen. Jeder Schritt baut auf dem vorherigen auf, um schnelle, genaue und anatomisch konsistente Masken zu liefern.
Herz-ROI-Lokalisierung mit CNNs
In der ersten Phase kommt ein leichtgewichtiges konvolutionales neuronales Netzwerk zum Einsatz, um die Herzregion in jedem MRT-Slice zu lokalisieren. Durch das Training an Rohbildern mit manuell annotierten Begrenzungsrahmen lernt das Netzwerk, nicht relevante Anatomie (wie Lunge und Brustwand) herauszuschneiden und sich ausschließlich auf die Herzkammern zu konzentrieren.
Dieses gezielte „Region of Interest“ (ROI) Ausschnitten reduziert die nachgelagerte Komplexität und steigert sowohl die Geschwindigkeit als auch die Genauigkeit.
Segmentierungs-Rückgrat: U-Net & Stapel-Auto-Encoder
Sobald die ROI extrahiert ist, umreißt ein Segmentierungsnetz die Kammergrenzen:
- U-Net-Varianten: Viele hochrangige Studien verwenden eine 2D-U-Net-Architektur, die durch einen Encoder-Decoder-Weg gekennzeichnet ist, der 3×3-Faltungen, Batch-Normalisierung, ReLU-Aktivierungen und Skip-Verbindungen verwendet, um den räumlichen Kontext zu bewahren. Die Filtertiefe hat typischerweise Fortschritte von 32 zu 64 zu 128 zu 256 und balanciert die Detailaufnahme gegenüber den Rechenkosten aus.
- Gestapelte Auto-Encoder (Plakatmethode): Die Pipeline des Posters verwendet stattdessen einen gestapelten Auto-Encoder, der dafür trainiert wurde, die ROI-Eingabe zu reproduzieren und dabei implizit Formvorstellungen der Kammern zu lernen. Die Engstelle zwingt das Netzwerk, wesentliche kardiale Merkmale zu destillieren, was zu einer initialen pixelweisen Maske führt, die in die Verfeinerungsphase eingespeist wird.
Fusion von deformierbaren Modellen für makellose Grenzen
Rohe Deep-Learning-Masken können an komplexen Grenzen leicht gezackt oder fehljustiert sein. Um anatomische Plausibilität sicherzustellen, wird die ursprüngliche Kontur in ein klassisches deformierbares Modell (aktives Konturmodell) integriert:
- Initialisierung: Der Ausgang des Auto-Encoders oder U-Net liefert die Startkurve.
- Energie-Minimierung: Form- und Intensitätsbegriffe lenken die Kontur eng an die realen Kammerkanten.
- Ausgaben-Glättung: Die finale Maske ist sowohl glatt als auch anatomisch genau, indem sie kleinere Deep-Learning-Artefakte ohne manuelle Intervention korrigiert.
Dieses dreistufige Design kombiniert die Geschwindigkeit und Lernkraft von CNNs mit der geometrischen Strenge deformierbarer Modelle.

Das Training des Netzwerks: Rezepte für starke Segmentierung
Der Aufbau eines Modells, das auf Patienten und Scanner verallgemeinert, hängt von sorgfältig gewählten Verlustfunktionen, intelligenter Augmentation und rigorosen Validierungsprotokollen ab.
Intelligente Verluste: Dice trifft Kreuzentropie
Reine Kreuzentropie optimiert die pixelgenaue Genauigkeit, kann jedoch mit Klassenungleichgewicht kämpfen, wenn die Kammern nur einen Bruchteil des Bildes einnehmen. Dice-Verlust maximiert die Überlappung, kann jedoch zu Beginn des Trainings instabil sein. Ihre Kombination produziert das Beste aus beiden Welten:
- Gewichtete Kreuzentropie: bestraft falsch klassifizierte Pixel und hält das Netzwerk in der voxelgenauen Richtigkeit geerdet.
- Dice-Verlust: maximiert direkt die Überlappung zwischen der Vorhersage und der Grundwahrheit, wodurch die Abgrenzung der Grenzen verbessert wird.
- L2-Regularisierung: Zähmt übermäßig große Gewichte, um eine sanftere Konvergenz zu erreichen.
Studien berichten, dass dieser hybride Verlust besser abschneidet als jede Komponente allein – die durchschnittlichen Dice-Werte bei zurückgehaltenen MRT-Datensätzen um 2–3 Prozentpunkte steigert.
Datenaugmentation zur Überwindung der Scanner-Variabilität
Die Protokolle der Herz-MRT variieren stark – Feldstärken, Schnitthöhen, Bildgebungsplanes – daher simulieren Augmentationen diese Vielfalt.
- Geometrische Transformationen: Rotationen (z. B. Vielfaches von 60°), Skalierungen, Übersetzungen, Spiegelungen
- Elastische Deformationen: zufällige glatte Verkrümmungen ahmen anatomische Variabilität und Atembewegungen nach.
- Intensitätsverschiebungen: Kontrast- und Helligkeitsfluktuationen berücksichtigen Unterschiede in der Scannerkalibrierung.
Die augmentierte On-the-fly sorgt dafür, dass das Modell eine nahezu unendliche Vielzahl von Beispielen sieht, wodurch Überanpassung drastisch reduziert und die Leistung über Anbieter hinweg verbessert wird.
Optimierungs- & Validierungsstrategie
Ein intensives Trainingsregime stellt sicher, dass Sie wirklich die Herz-Anatomie und nicht die Besonderheiten des Datensatzes erlernen.
- Optimierer: Adam oder SGD mit einer anfänglichen Lernrate von ~1×10⁻⁴, halbiert alle 10–20 Epochen, um Gewichte zu verfeinern.
- Frühzeitiges Stoppen: Überwachung der Validierungs-Dice; stoppen, wenn die Verbesserung bei 10 aufeinanderfolgenden Epochen stagniert.
- Kreuzvalidierung: 5-fache Splittungen auf Benchmark-Sets (ACDC, MICCAI RV/LV), um die Stabilität zu bewerten und glückliche Splits zu vermeiden.
Zusammen sorgen diese Entscheidungen für ein Gleichgewicht zwischen Konvergenzgeschwindigkeit und Verallgemeinerung, um klinisch valide Konturen unter realen Bedingungen zu liefern.
Nachweis der Leistung: Metriken, die zählen
Beurteilung der MRT-Segmentierung Die Qualität stützt sich auf drei zentrale Metriken. Jede erfasst einen bestimmten Aspekt, wie genau die automatische Maske mit den Expertendelineationen übereinstimmt.
Dice-Similaritätskoeffizient (DSC)
Der DSC misst die volumetrische Überlappung zwischen prognostizierten und tatsächlichen Masken. Die Werte reichen von 0 (keine Überlappung) bis 1 (perfekte Überlappung). Modelle der neuesten Generation erreichen routinemäßig DSC > 0,90 sowohl für den linken als auch für den rechten Ventrikel und haben eine Genauigkeit, die mit der von Expertenlesern vergleichbar ist.
Hausdorff-Distanz (HD)
Die HD quantifiziert den schlimmsten Randfehler in Millimetern und ist definiert als die größte Entfernung von einem Punkt auf einer Kontur zum nächsten Punkt auf der anderen. Ein niedriger HD (< 10 mm) zeigt an, dass die Maske die feinen anatomischen Kanten genau verfolgt.
Die Berichterstattung über den Durchschnitt und die Standardabweichung der HD hilft dabei, Konsistenz über die Patienten-Scans hinweg zu enthüllen.
Volumenkorrelation (R)
Korrelationskoeffizienten werden verwendet, um automatische und manuelle Messungen des enddiastolischen Volumens (EDV), endsystolischen Volumens (ESV) und der Ejektionsfraktion (EF) zu vergleichen. Hohe R-Werte (≥ 0,99) zeigen an, dass das Modell klinisch äquivalente quantitative Metriken erzeugt und damit Vertrauen in nachgelagerte funktionale Indizes gewährleistet.
Klinische Auswirkungen: Schneller, konsistent, skalierbar
Die kamerabasierte Segmentierung durch Deep Learning transformiert klinische Abläufe auf drei wesentliche Arten.
Automatisierte Berichterstattung der Ejektionsfraktion
Durch die Bereitstellung genauer ventrikulärer Volumina innerhalb von Sekunden ermöglicht die KI-gestützte Segmentierung die sofortige Berechnung des enddiastolischen Volumens (EDV), des endsystolischen Volumens (ESV) und der Ejektionsfraktion (EF). Diese schnelle Bearbeitung beschleunigt die Diagnosen und unterstützt rechtzeitige Anpassungen der Behandlung ohne Verzögerungen beim manuellen Nachzeichnen.
Minimierte Interbeobachtervariabilität
Die traditionelle manuelle Abgrenzung leidet unter Reader-to-Reader-Unterschieden – kleine Konturverschiebungen können zu erheblichen EF-Abweichungen führen.
Deep-Learning-Modelle erreichen Dice-Werte von ≥ 0,90 und Volumenkorrelationen von ≥ 0,99, was konsistente Messungen gewährleistet und das Vertrauen der Kliniker:innen in die Patientenüberwachung stärkt.
Nahtlose PACS/RIS-Integration
Sobald das Netzwerk trainiert ist, kann die Pipeline direkt in Picture Archiving and Communication Systems (PACS) integriert werden, die von Plattformen wie Medicai oder Radiology Information Systems (RIS) bereitgestellt werden.
Der vollautomatische Prozess erfordert keine Benutzerinteraktion und leitet die finalisierten Konturen sowie quantitative Berichte in die elektronische Patientenakte weiter. Sie vereinfachen die Arbeitsabläufe in der Radiologie.
Überwindung von Hindernissen: Einschränkungen & Lösungen
Trotz ihrer Verheißungen muss KI in der MRT Segmentierungspipelines drei anhaltende Herausforderungen angehen, um eine breite klinische Akzeptanz zu erreichen.
Scanner-Variabilität
Unterschiede in der Feldstärke, podspeziellen Sequenzen und Schnitthöhen können die Modellleistung beeinträchtigen.
Lösungen umfassen umfangreiche Datenaugmentation während des Trainings (Rotationen, Intensitätsfluktuationen, elastische Deformationen) und eine Feinabstimmung an kleinen Batches von Scans neuer Standorte, um sich an lokale Protokolle anzupassen.
Seltene Pathologien (z. B. Hypertrophie)
Ungewöhnliche Bedingungen wie asymmetrische septale Hypertrophie oder angeborene Malformationen erscheinen möglicherweise nicht in standardmäßigen Trainingssätzen. Dies kann zu Untersegmentierung oder Formverzerrungen führen.
Milderungsstrategien umfassen gezielte Fallkollektionen, synthetische Augmentation für extreme Anatomien und die Verwendung von Unsicherheitsschätzungen, um low-confidence Ausgaben zur Überprüfung zu kennzeichnen.
Engpässe bei der Datenannotation
Hochwertige manuelle Konturen sind arbeitsintensiv und kostenintensiv, wodurch die Größe der Trainingskorpora begrenzt wird.
Methoden wie semi-supervised learning, federated learning und active learning können den Bedarf an annotierten Daten reduzieren, indem sie unmarkierte Scans nutzen, Updates ohne Datenübertragung teilen und sich auf schlüsselrelevante Fälle konzentrieren.
Fazit
Automatisiertes Deep Learning ermöglicht eine schnelle und genaue Segmentierung von Herzkammern in der Herz-MRT und bietet in Sekunden präzise Umrisse. Es kombiniert CNN zur Lokalisierung, U-Net zur Verarbeitung und deformierbare Modelle zur Verfeinerung, um Kliniker:innen zuverlässige Ergebnisse zu liefern.
Mit Medicai’s schlüsselfertiger PACS-Integration, föderierten Modell-Updates und erklärbaren Dashboards können Sie diese hochmoderne Pipeline sofort implementieren. Mit uns können Sie schneller, intelligenter kardiologische Versorgung für jeden Patienten bieten.




